|
|
HIV und monoklonale Gammopathie Manfred Hensel Ein typisches Laborphänomen bei der Erstdiagnose einer HIV-Infektion ist die polyklonale Immunglobulinstimulation. Gelegentlich wird die HIV-Infektion bei der Abklärung einer polyklonalen oder monoklonalen Immunglobulinvermehrung erstmals festgestellt. Tritt die monoklonale Gammopathie (siehe Grafik) ohne weitere Krankheitszeichen auf, d.h. kein Nachweis von Osteolysen, Plasmazellanteil im Knochenmark unter 10 %, Paraproteinspiegel niedrig, keine Lymphome, Anämie, Niereninsuffizienz oder Hyperkalzämie, so lautet die Diagnose "monoklonale Gammopathie unklarer Signifikanz" (MGUS). Bei HIV-negativen Individuen wird eine MGUS umso häufiger diagnostiziert, je älter die Patienten sind. Ca. 5 % der Bevölkerung über 70 Jahre hat eine monoklonale Gammopathie, der Anteil ist höher bei 80 oder 90 jährigen (Kyle 2006). Ca. 25 % der Patienten mit MGUS entwickeln im Laufe von ca. 20 Jahren ein Multiples Myelom(Kyle 2002).
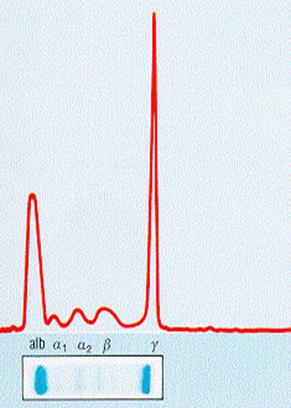
Eiweißelektrophorese mit M-Gradient, monoklonale Bande in der Immunfixationselektrophorese Welche Bedeutung das Auftreten einer monoklonalen Gammopathie bei HIV-Infizierten hat, ist bisher nicht sehr gut erforscht. Wenngleich indolente Lymphome bei HIV-Infizierten ein relativ seltenes Phänomen im Vergleich zu den aggressiven Lymphomen sind, ist die Inzidenz z.B. eines Multiplen Myeloms dreimal so hoch wie bei Nicht-Infizierten. Es stellt sich die Frage, wie häufig das Auftreten einer monoklonalen Gammopathie heutzutage beim breiten und immer frühzeitigeren Einsatz der ART ist, ob es früh im Verlauf der Infektion auftritt oder erst später und welche Bedeutung es für die Morbidität und Mortalität hat. Kann das Auftreten oder das Ausmaß einer monoklonalen Gammopathie die Entwicklung eines Myeloms oder anderer lymphoproliferativer Erkrankungen voraussagen? Die Ursache der Gammopathie im Kontext HIV ist vielschichtig. Der progressive Verlust der CD4-Lymphozyten ist das zentrale Ereignis der HIV-Infektion. Zusätzlich ist aber auch eine abnorme Funktion der B-Lymphozyten in allen Stadien der HIV-Infektion gut beschrieben. Sie ist charakterisiert z.B. durch abnorm niedrige Antikörperspiegel gegen spezifische Pathogene und eine schlechte Impfantwort. Paradoxerweise ist der Serumspiegel der Immunglobuline, vor allem der Subtyp IgG, erhöht. Er ist Ausdruck einer unspezifischen polyklonalen B-Zell-Aktivierung. Diese ist zurückzuführen auf eine dysregulierte T-Zell-Funktion, hohe Spiegel an Interleukin-6 und 10 sowie auch durch direkte Interaktion von HIV mit B-Zellen. Neben der Stimulation durch HIV selbst werden die B-Zellen auch durch andere Antigene, Mitogene oder zusätzliche Erreger stimuliert, zum Beispiel HBV, HCV, EBV oder HHV-8. Die chronische polyklonale Expansion der B-Lymphozyten resultiert in einer follikulären Hyperplasie in vergrößerten, reaktiven Lymphknoten, der so genannten "persistierenden generalisierten Lymphadenopathie", sowie einer polyklonalen Hypergammaglobulinämie. Hält dieser Prozess lange an, so kann es zu einer klonalen Selektion von abnormen B-Lymphozyten kommen. Der Prozess der Entwicklung von malignen Lymphomen bei HIV-Infizierten ist jedoch vielschichtiger. In Zusammenhang mit der reduzierten Immunüberwachung bei einer fortgeschrittenen HIV-Infektion kann zum Beispiel EBV auf verschiedenen Wegen zu maligner Transformation der Lymphozyten führen. Auch HCV kann B-Zellen infizieren, chronisch stimulieren und deren Funktion stören. Die Assoziation von HCV mit monoklonaler Gammopathie, gemischter Kryoglobulinämie, Autoimmunerkrankungen und Lymphomen ist lange bekannt. Eine ganze Reihe von meist retrospektiven Studien zur Häufigkeit der monoklonalen Gammopathie bei HIV-infizierten, überwiegend mit kleinen Fallzahlen, wurde in den vergangenen 3 Jahrzehnten publiziert. In den älteren Publikationen aus den achtziger Jahren wurden Prävalenzen von 2,5-12 % beobachtet. Neuere Arbeiten aus der HAART-Ära, publiziert nach 2000, geben durchgehend eine Prävalenz der monoklonalen Gammopathie von ca. 3-5 % in der HIV-infizierten Population an. In einer Querschnittsuntersuchung bei 320 HIV-infizierten aus Boston (viele unter ART, genauer Anteil unklar) korrelierte das Auftreten der monoklonalen Gammopathie mit jüngerem Alter, hoher Viruslast und höherer Helferzellzahl (Konstantinopoulus 2007). Eine aktuelle Pilotstudie innerhalb der Multicenter AIDS Cohort Study untersuchte Serumproben von 172 HIV-Infizierten kurz vor Beginn der ART und Proben einer Kontrollgruppe von 166 HIV-negativen Individuen. Der Serumspiegel von IgG, A, M und freien Leichtketten (FLC) war signifikant höher bei HIV-positiven, ebenso die Kappa/Lambda-Ratio und die MGUS-Prävalenz (2,3 % versus 0 %) (Breen 2010). Eine Studie an Serum- und Urinproben von 368 HIV-Infizierten aus Südafrika zeigte, dass das Auftreten monoklonaler Banden (in 3,2 %) nicht mit der CD4-Zahl und der Viruslast korrelierte (van Vuuren 2010). Bei 25 HIV-infizierten Personen mit monoklonaler Gammopathie zeigte sich, dass deren Alter deutlich geringer war als bei MGUS-Patienten ohne HIV-Infektion. Die Präsenz zusätzlicher anderer viraler Infektionen wie HBV, HCV und HHV 8 war hoch. Die Patienten hatten durchgehend gute Helferzellen (Median 350/mm3). Bei einigen Patienten ging durch Einleitung einer ART das Paraprotein zurück (Amara 2006). Die m.E. wichtigste Studie zur Bedeutung der monoklonalen Gammopathie und der freien Leichtketten wurde kürzlich von der Arbeitsgruppe am NCI publiziert. In einer Case-Control-Studie wurden 66 HIV-infizierte Patienten mit diagnostiziertem NHL (allesamt aggressiv) verglichen mit 225 HIV-positiven Kontrollpersonen. Von allen wurden eingelagerte Serumproben aus den 5 Jahren vor NHL-Diagnose oder Studieneinschluss untersucht. Es zeigte sich, dass k- undλ-FLCs bei NHL-Patienten 2-5 Jahre vor Diagnose signifikant höher waren. Der Spiegel der FLCs war dosisabhängig hoch prädiktiv für die Entwicklung eines NHL (RR 3.7 für k-FLCs, 8.1 für λ-FLCs 2-fach über der Norm). Es fand sich keine Korrelation mit IgG, A, oder M-Serumspiegeln oder dem M-Protein. Ein solches wurde bei 3% der NHL-Patienten und 4% der Kontrollen gefunden. Der prädiktive Wert der FLCs hing von der Anzahl der Helferzellen ab. Er war deutlicher bei höheren Helferzellen (> 100/mm3). Eine abnorme FLC-Ratio wurde bei 20 % der Patienten, die später ein NHL entwickelten, gefunden. Die Autoren schlussfolgern, dass FLCs ein sensitiver Marker für B-Zell-Aktivierung und -Dysfunktion sind und hilfreich zur Identifikation von HIV-Infizierten mit erhöhtem NHL-Risiko sein könnten (Landgren 2010). In einer retrospektiven Studie bei 1219 Eiweißelektrophoresen in einer großen HIV-Kohorte zwischen 1997 und 2012 fanden sich 137 (11,3%) monoklonale Gammopathien in einer Altersgruppe von im Median 41 Jahren (Casanova 2015). Nach einem medialen Follow-up von 6,8 Jahren war der M-Gradient bei 66,2% der Patienten verschwunden. Das Verschwinden war assoziiert mit einer erfolgreichen ART und dem Fehlen einer Hepatitis C. Welche Schlussfolgerungen können aus diesen Beobachtungen gezogen werden? Zunächst einmal sollte bei jeder Abklärung der Ursache einer monoklonalen oder polyklonalen Immunglobulinstimulation immer ein HIV-Test durchgeführt werden. Mit dem Auftreten einer monoklonalen Gammopathie kann bei ca. 3-5 % der HIV-infizierten gerechnet werden. Wahrscheinlich ist sie bei HIV-Infizierten nicht prädiktiv für die Entwicklung von Lymphomen, weder von indolenten noch von aggressiven. FLCs sind möglicherweise aussagekräftiger. Die Auswirkung der ART auf den prädiktiven Wert der FLCs ist noch unklar. Möglicherweise kann, wenn sich diese Befunde in weiteren Studien bestätigen, der Spiegel oder die Ratio der FLCs mit einbezogen werden bei der Indikation zur Einleitung einer ART. Größere prospektive Studien mit regelmäßiger, evtl. jährlicher Bestimmung von B-Zell-Aktivierungsmarkern wie z.B. Eiweißelektrophorese, Immunglobulinspiegel, sCD30 oder FLCs, könnten die Bedeutung dieser Parameter bei der Prädiktion von malignen Lymphomen und anderen Komplikationen sowohl bei behandelten als auch unbehandelten Patienten zukünftig genauer evaluieren. |




Seite zuletzt geändert am 16.11.2018 16:28:00 |