HIV und das Immunsystem
Die Infektion mit dem HI-Virus löst eine starke Aktivierung zellulärer und humoraler Reaktionen des Immunsystems aus. Hierdurch wird zunächst ein Großteil der Viren eliminiert. Da das Virus in der initialen Phase der Infektion in sehr großen Mengen produziert wird und eine hohe Mutationsrate aufweist, ist der Körper letztendlich nicht in der Lage die Infektion vollständig abzuwehren. Die chronische Persistenz von HIV führt zu einer andauernden Hyperreaktivität des Immunsystems mit nachfolgend zunehmender Immundefizienz.
Nach dem Eindringen von HIV meist über Schleimhäute in den Körper, wird das Virus von so genannten "Dendritischen Zellen" (DC), welche zahlreich dicht unter der Schleimhautoberfläche liegen, aufgenommen. Diese zu den Makrophagen (Fresszellen) zählenden DC sind in der Lage, nach Aufnahme des Virus T-Zellen massiv zu stimulieren. In der chronischen Phase benutzt HIV CD4-Zellen zu seiner Vermehrung. Die Aktivierung der CD4-Zellen führt zu einer Integration der viralen DNA in den Zellkern.
Eine Immunstimulation, zum Beispiel durch Influenza, Tetanus Toxoid (also auch durch Impfungen) oder Mycobacterium Tuberculosis kann dann zu einer vermehrten Virusproduktion durch die CD4-Zellen führen.
Gleichzeitig proliferieren zytotoxische T-Zellen (CD8 positive T-Lymphozyten, CTL). Diese können die Produktion von HIV kontrollieren. Natürliche Killerzellen (NK-Zellen) und Monozyten erkennen virusinfizierte CD4 positive Zellen und töten diese ab. Hierbei werden zahlreiche Zytokine freigesetzt, die weitere Kompartimente des Immunsystems stimulieren und auch hemmen können. Insgesamt verursacht die Infektion mit HIV sowohl eine Immunstimulation mit Hypergammaglobulinämie, in deren Rahmen es auch zu Zeichen der Autoimmunität kommen kann, als auch zu einer Immunsuppression.
Immunsuppression
Eine Immunsuppression wird durch die
- Störung der Aktivierung von T-Helferzellen
- Störung der Thymusfunktion
- einen selektiven Verlust von Gedächtnis T-Zellen
- durch eine gesteigerte Apoptose und
- durch eine gestörte Expression HIV spezifischer Epitope auf T-Zellen
vermittelt.
Durch die letztgenannten Mechanismen wird die Interaktion von antigenpräsentierenden Zellen (APC) mit T-Zellen gestört. Insbesondere werden zu Beginn der Infektion HIV spezifische CD4 Zellen erkannt und ausgeschaltet. Über einen längeren Zeitraum (10-15 Jahre) führt dies auch zu einer verminderten Funktion der HIV spezifischen zytotoxischen T-Zellen (CTL) aufgrund der abnehmenden T-Zell-Hilfe.
Weiterhin führt der kontinuierliche Verlust von CD4 positiven T-Lymphozyten in Gegenwart von großen Virusmengen (CD4 < 350/µl und > 50 000 HIV-RNA Kopien/ml Plasma) zu einer deutlichen Störung der Thymusfunktion.
Die Aktivierung der CD4-Zellen induziert eine gesteigerte Apoptose (geplanter Zelltod). Zusätzlich wird ein durch Virusproteine auf der Oberfläche von CD4-Zellen induziertes Abtöten dieser CD4 Zellen durch Killerzellen veranlasst. Diese beiden Mechanismen führen zu einem sehr hohen Umsatz der CD4 positiven T-Zellen (2x109 Zellen/Tag). Die Halbwertzeit von produktiv infizierten CD4-Zellen sinkt auf 1,6 Tage. Obgleich der Thymus etwa 4 x 10 6 naive, CD4 positive Zellen pro Tag freisetzt, wird durch diesen unphysiologisch hohen Umsatz an CD4-Zellen das Immunsystem vorzeitig erschöpft. Die Folge ist ein fortschreitender Immundefekt.
CD8 positive T-Zellen spielen bei der initialen Immunantwort nach erfolgter HIV-Infektion eine wesentliche Rolle. Spezialisierte CD8-Zellen (cytolytische T-Zellen, CTL) lysieren HIV-infizierte CD4-Zellen. Die gleichen Zellen produzieren Chemokine, die an diejenigen Chemokin-Rezeptoren binden und damit blockieren, die HIV selbst beim Eintritt in die CD4-Zellen benötigt. Über diese Mechanismen kontrollieren CD8 positive Zellen partiell die HIV-Replikation in der ersten Phase der Virämie. Hier spielt die Fähigkeit der CD8-Zellen ein immunologisches Gedächtnis auszubilden, um bei einem Zweitkontakt mit den HIV-Proteinen (gag, pol, env und nef) spezifisch zu reagieren, eine entscheidende Rolle.
Daneben sind sowohl die Cytokin-Synthese als auch die Fähigkeit zur HIV spezifischen Proliferation wichtige Mechanismen der HIV-Kontrolle. Eine verminderte Cytokin-Sekretion findet sich bei allen nicht therapierten HIV-Patienten.
Die HIV spezifische CD4 Proliferation lässt sich jedoch nur in einem kleinen Teil der Patienten beobachten, welche als "Langzeit nicht progrediente Patienten" (Longterm-non-progressors, oder LTNP) bezeichnet werden. Diese LTNP-Patienten sind in der Lage, auch ohne antiretrovirale Therapie (ART) bei niedrigen oder nicht messbaren Viruslasten die Zahl ihrer CD4 positiven Zellen stabil zu halten. Diese LTNP-Patienten haben zusätzlich eine sehr starke HIV spezifische CD8-Zell-Reaktivität.
CD4-Zelldifferenzierung und Turnover:
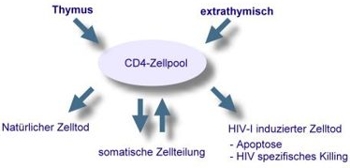
Im Verlauf der Erkrankung werden die für T-Helferzellen des Typs TH1 spezifischen Zytokine (IL2, IFN-γ, IL12, TNF-α) zugunsten der TH2 spezifischen Zytokine (IL4, IL5) vermindert synthetisiert. Durch Effekte von IL4 und IL5 kommt es zu einer Hypergammaglobulinämie und zu der vermehrten Allergieneigung in fortgeschrittenen Stadien der HIV-Infektion.
Autoimmunphänomene
Eine Hypergammaglobulinämie findet sich schon im Frühstadium der Infektion. Diese wird vermutlich durch den stärker werdenden Einfluß der von TH2 positiven T-Zellen produzierten Zytokinen (IL4, IL5) bedingt. Meist sind die IgG-Antikörper polyklonal erhöht, es findet sich daneben aber auch eine gesteigerte Produktion von spezifischen Autoantikörpern. Der Anstieg von Antikörpern der Immunglobulinklasse IgA im Serum (> 5 g/L) ist ein prognostisch ungünstiger Marker im Verlauf der Erkrankung.
Je nach Ausmaß der Hypergammaglobulinämie können Störungen der Plasmaviskosität auftreten. In Einzelfällen kann, ähnlich wie bei der Hepatitis C-Infektion, eine kältelabile Immunglobulin-Fraktion (Kryoglobuline) zu thrombotischen Verschlüssen von Kapillaren und Arteriolen in der Peripherie führen. Diese sind gelegentlich mit dem Auftreten von Paraproteinen vergesellschaftet. In Folge einer permanent hohen HIV-Last können zusätzlich zirkulierende Immunkomplexe (CIC) entstehen, welche eine Immunkomplexnephritis induzieren können. Diese Phänome bilden sich mit Einsatz einer wirksamen antiretroviralen Therapie und einer Senkung der Viruslast zurück.
Im Rahmen der polyklonalen Immunglobulinvermehrung werden die folgenden Autoantikörper gefunden:
- Antinukleäre Antikörper (ANA)
- Antizytoplasmatische Antikörper gegen neutrophile Granulozyten (p/c-ANCA)
- Rheumafaktoren (gegen IgG gerichtete Antikörper der Klasse IgG, IgA oder IgM)
- Antiphospholipidantikörper (APLA), IgG, IgA, Myelin-AK
- Antizelluläre Autoantikörper gegen:
- Thrombozyten (Kreuzreaktion mit gp 120)
- Lymphozyten/ß-Kette MHC II (Kreuzreaktion mit gp 41)
- Granulozyten (spezifische IgG)
- Erythrozyten (unspezifische Bindung von zirkulierenden Immunkomplexen)
- CD4 (Antikörper gegen gp120 auf der Oberfläche von produktiv infizierten CD4-Zellen)
Die ANA und ANCA oder Rheumafaktoren bleiben meist ohne spezifische pathologische Relevanz. Antizelluläre Antikörper können dagegen zu schweren Zytopenien führen und müssen im Fall einer Thrombopenie mit Steroiden therapiert werden. Weiterhin können aufgrund von kreuzreagierenden IgM- und IgG-Antikörpern verschiedene zur Infektdiagnostik verwendete Komplementbindungsreaktionen (KBR) falsch positiv ausfallen.
Veränderungen der Immunfunktionen unter antiretroviraler Therapie (ART)
Ist die antiretrovirale Therapie (ART) erfolgreich (Senkung der Viruslast unter die Nachweisgrenze des verwendeten Testsystems), wird die pathologisch gesteigerte T-Zell-Teilungsrate insgesamt reduziert. Die CD8 Zell-Proliferation kann sich im Verlauf der Therapie normalisieren. Der Verlust von CD4-Zellen durch Apoptose wird bereits nach einer Woche Therapie vermindert.
Der Anstieg der CD4 Zellen kann in 2 Phasen unterteilt werden:
Zu Beginn der ART werden präformierte reife CD4-Zellen, sogenannte Gedächtniszellen (CD4+/CD45RO+), aus dem lymphatischen Gewebe mobilisiert. Hierdurch steigt die CD4-Zellzahl zunächst rasch um bis zu 50 Zellen/Monat an. In der zweiten Phase erreichen die Gedächtniszellen ein Plateau und der weitere langsamere Anstieg der CD4-Zellen wird durch im Thymus neu geprägte naive Zellen (CD4+/CD45RA+) gespeist. Das Ausmaß des CD4-Anstieges ist von den folgenden Faktoren abhängig:
- Alter des Patienten
- Thymusaktivität
- CD4-Zellzahl zu Beginn der Therapie
- Infektdauer
- Initiale Viruslast und Immunaktivierung
- Kapazität der CD4 Progenitorzellen
- Ausmaß der Reduktion der Viruslast durch die ART
Bei sehr schnellem Anstieg dieser "naiven" CD4-Zellen besteht die Gefahr de Auftretens eines "Immunrekonstitutions-Syndroms" (IRIS), siehe dort.
Immunrekonstitution und deren Messmethoden:
Durch den Einsatz einer antiretroviralen Kombinationstherapie werden zunächst reife, später auch naive CD4-Zellen in die Zirkulation frei gegeben. Die Population von im Thymus neu gebildeten naiven T-Zellen kann mit Hilfe der Bestimmung von "T-cell-receptor-exicion-cycles" (TREC), die bei der Neuformation des T-Zellrezeptors naiver T-Zellen im Thymus entstehen, quantifiziert werden. Die Ursache für eine Verminderung von TREC positiven Zellen kann eine gestörte Thymusfunktion sein. Langfristig findet sich demnach ein Ersatz der reifen, latent infizierten CD4-Zellen durch naive CD45RA positive, nicht infizierte CD4-Zellen.
Eine Eradikation des Virus auf diese Weise ist wegen der unterschiedlichen Wirksamkeit der ART in den verschiedenen Kompartimenten des Immunsystems derzeit nicht möglich.
Durch die Senkung der Viruslast vermindert sich die Überstimulation des Immunsystems und normalisiert sich schließlich. Der Abfall der Zahl der CD8 positiven T-Zellen und der Anstieg der CD4-Zellen bedingt einen Anstieg der CD4/CD8-Ratio von unter 1 auf Werte im Normalbereich (CD4/CD8-Ratio 1.3-3,3). Daneben wird der Aktivierungsmarker CD38 auf CD8 positiven Killerzellen vermindert exprimiert. Dies ist ein weiteres Zeichen für den Rückgang der T-Zellaktivierung durch virusinfizierte Zellen in der Zirkulation. Diese Verschiebungen nehmen in Abhängigkeit von der bei Beginn der ART bestehenden Schädigung des Immunsystems mehrere Jahre in Anspruch.
Die wachsende Immunkompetenz zeigt sich durch eine Zunahme von Antigen spezifischen T-Zellen mit einer Spezifität gegen Tetanus Toxoid, Candida- und CMV-Antigene. Diese vermindert das Risiko für das Auftreten dieser Erkrankungen.
Die Funktion der spezifischen T-Zellen kann in aufwendigen in vitro Testsystemen in dafür spezialisierten Labors überprüft werden. Durch die Regeneration von Antigen spezifischen T-Zellen kann auf die Prophylaxe gegen primäre opportunistische Infektionen (Candida, Pneumocystis jirovecii Pneumonie etc.) bei stabilem Verlauf verzichtet werden.
Das nachfolgende Schema fasst die Dynamik der durch eine effektive antiretrovirale Therapie zu erzielenden Effekte auf die Virus produzierenden Kompartimente des Immunsystems und auf die an der möglichen Immunrekonstitution beteiligten Zellpopulationen noch einmal zusammen:
| Eradikation |
Rekonstitution |
|
| Stunden |
freie HIV-Partikel im Plasma |
Deaktivierung von T-Zellen |
| Wochen |
produktiv infizierte CD4 |
memory T-Zellen (CD4/CD45 R0) |
| Monate |
latent infizierte CD4 |
naive T-Zellen (CD4/CD45 RA) |
| Jahre |
langlebige Zellen (Makrophagen,dendritische Zellen) |
Antigen präsentierende Zellen (Makrophagen, B-Zellen dendritische Zellen) |
Literatur
1. Hoffmann C, Rockstroh J, Kamps BS. HIV.NET, 2017